El pH es una unidad de medida de la acidez del vino que encontramos cada vez con más frecuencia en las fichas técnicas o en las etiquetas de nuestras botellas. El nivel de pH nos puede dar información sobre algunas características del vino pero para ello debemos entender como funciona y qué expresan realmente sus diferentes cifras.
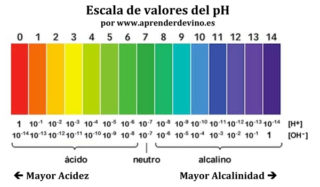
Desde un punto de vista sencillo podemos decir que el pH mide el grado de acidez o de alcalinidad de una disolución obtenida de cualquier elemento o sustancia. Esta unidad de medida se distribuye a lo largo de una escala que va desde el 0 hasta el 14, tomándose el 7 como neutro, siendo los valores más cercanos a 0 los que indican que esa disolución es más ácida y los valores más cercanos a 14 los que indican que esa solución es más alcalina o básica, como también se denomina.
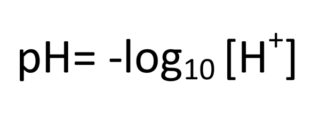 Desde la perspectiva científica la definición de pH es más complicada pero nos interesa conocerla porque, como veremos más adelante, tiene implicaciones importantes en las características de los vinos. El término pH procede de potencial de hidrógeno (o potencial de hidrogeniones) ya que indica la concentración de iones hidrógeno presentes en una sustancia. A mayor concentración de iones hidrógeno mayor acidez (cifras más cercanas a cero) y a menor concentración mayor alcalinidad (cifras más cercanas a 14). El pH se define como el logaritmo negativo de base 10 de la actividad de los iones hidrógeno.
Desde la perspectiva científica la definición de pH es más complicada pero nos interesa conocerla porque, como veremos más adelante, tiene implicaciones importantes en las características de los vinos. El término pH procede de potencial de hidrógeno (o potencial de hidrogeniones) ya que indica la concentración de iones hidrógeno presentes en una sustancia. A mayor concentración de iones hidrógeno mayor acidez (cifras más cercanas a cero) y a menor concentración mayor alcalinidad (cifras más cercanas a 14). El pH se define como el logaritmo negativo de base 10 de la actividad de los iones hidrógeno.
 Dejando esta compleja definición al margen podemos decir que la escala del pH que manejamos se expresa sólo entre 0 y 14 porque es una medida logarítmica, sino las cifras serían mucho más largas. Esto significa en términos sencillos que una determinada cifra de la escala, por ejemplo 3, tiene diez veces más actividad de iones hidrógeno que 4 y ésta a su vez diez veces más que 5 o dicho de otra manera una sustancia con un pH de 3 es diez veces más ácida que una con 4 y ésta a su vez es diez veces más ácida que una con 5. Cuando expresemos cifras de pH debemos tener presente que variaciones tan pequeñas como 0,1 reflejan variaciones muy importantes en las características ácidas o alcalinas de esas sustancias.
Dejando esta compleja definición al margen podemos decir que la escala del pH que manejamos se expresa sólo entre 0 y 14 porque es una medida logarítmica, sino las cifras serían mucho más largas. Esto significa en términos sencillos que una determinada cifra de la escala, por ejemplo 3, tiene diez veces más actividad de iones hidrógeno que 4 y ésta a su vez diez veces más que 5 o dicho de otra manera una sustancia con un pH de 3 es diez veces más ácida que una con 4 y ésta a su vez es diez veces más ácida que una con 5. Cuando expresemos cifras de pH debemos tener presente que variaciones tan pequeñas como 0,1 reflejan variaciones muy importantes en las características ácidas o alcalinas de esas sustancias.
Desde el punto de vista del vino todo lo anterior es importante porque el vino es una bebida ácida y conocemos la relevancia que la acidez y los diferentes ácidos tienen en muchos y diferentes factores, desde la uva hasta la capacidad de envejecimiento, pasando por su propio estilo.
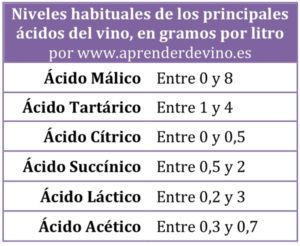 Cuando analizamos la acidez del mosto o del vino utilizamos el término Acidez Total para expresar la suma del volumen de todos de los ácidos presentes en él. Aunque la Acidez Total sea la suma de todos los ácidos, tanto fijos como volátiles, normalmente se expresa en gramos por litro (g/l) de tartárico, ya que es el ácido principal tanto en el mosto como en el vino, y normalmente la cifra se encuentra en el intervalo entre 5,5 y 8,5 g/l. Habitualmente se prefiere que los vinos blancos estén en la parte superior de este intervalo, con mayor acidez, y los vinos tintos en la parte inferior, con menor acidez. Esta cifra de Acidez Total es muy relevante para el personal de bodega ya que permite que se realicen las correcciones pertinentes en la acidez durante la elaboración de los vinos pero cada vez es más frecuente que fuera de la bodega la información sobre la acidez del vino venga expresada mediante la escala de pH.
Cuando analizamos la acidez del mosto o del vino utilizamos el término Acidez Total para expresar la suma del volumen de todos de los ácidos presentes en él. Aunque la Acidez Total sea la suma de todos los ácidos, tanto fijos como volátiles, normalmente se expresa en gramos por litro (g/l) de tartárico, ya que es el ácido principal tanto en el mosto como en el vino, y normalmente la cifra se encuentra en el intervalo entre 5,5 y 8,5 g/l. Habitualmente se prefiere que los vinos blancos estén en la parte superior de este intervalo, con mayor acidez, y los vinos tintos en la parte inferior, con menor acidez. Esta cifra de Acidez Total es muy relevante para el personal de bodega ya que permite que se realicen las correcciones pertinentes en la acidez durante la elaboración de los vinos pero cada vez es más frecuente que fuera de la bodega la información sobre la acidez del vino venga expresada mediante la escala de pH.
 El pH de la mayoría de los vinos se encuentra en el intervalo de 2,8 a 4, lo que lógicamente recae en el lado ácido de la escala. Un vino con un pH de 2,8 es extremadamente ácido mientras que uno con un pH en torno a 4 es plano, carente de acidez. Los vinos blancos suelen estar entre 3 y 3,3 y la mayoría de los tintos entre 3,3 y 3,6 aunque hay notables excepciones en función de distintas variables como la variedad de uva, clima, región o incluso prácticas de viticultura y de enología que definen el estilo del vino. Como regla general se intenta que los vinos no tengan un pH cercano o superior a 4 porque esta situación eleva el riesgo de oxidación y de perder la estabilidad del color además de aumentar el riesgo de contaminaciones microbianas. Las cifras entre las que se mueve el pH del vino pueden resultar engañosas ya que sus pequeñas diferencias nos pueden hacer creer erróneamente que las diferencias que suponen en el propio vino son poco relevantes. Para ilustrar su verdadera magnitud conviene recordar que un vino con un pH de 3,2 es aproximadamente un 25% más ácido que un vino con 3,3 de pH.
El pH de la mayoría de los vinos se encuentra en el intervalo de 2,8 a 4, lo que lógicamente recae en el lado ácido de la escala. Un vino con un pH de 2,8 es extremadamente ácido mientras que uno con un pH en torno a 4 es plano, carente de acidez. Los vinos blancos suelen estar entre 3 y 3,3 y la mayoría de los tintos entre 3,3 y 3,6 aunque hay notables excepciones en función de distintas variables como la variedad de uva, clima, región o incluso prácticas de viticultura y de enología que definen el estilo del vino. Como regla general se intenta que los vinos no tengan un pH cercano o superior a 4 porque esta situación eleva el riesgo de oxidación y de perder la estabilidad del color además de aumentar el riesgo de contaminaciones microbianas. Las cifras entre las que se mueve el pH del vino pueden resultar engañosas ya que sus pequeñas diferencias nos pueden hacer creer erróneamente que las diferencias que suponen en el propio vino son poco relevantes. Para ilustrar su verdadera magnitud conviene recordar que un vino con un pH de 3,2 es aproximadamente un 25% más ácido que un vino con 3,3 de pH.
A la vista de lo anterior podría parecer que cuando hablamos de vino la Acidez Total y el pH están expresando lo mismo, pero esto no es del todo cierto. Son dos medidas que están muy relacionadas pero a la vez son independientes. Para que podamos entenderlo de manera más sencilla podríamos decir que la Acidez Total mide la concentración (volumen o cantidad) de ácidos mientras que el pH mide la fuerza relativa de esos ácidos. Cambios en uno de ellos afectan al otro pero de una forma compleja ya que estos cambios no son proporcionales, como veremos más adelante. La Acidez Total es el principal componente del pH pero no el único y además, para complicar aún más las cosas, estas dos magnitudes se expresan de forma inversa.
Las cifras de Acidez Total expresan mayor acidez cuanto mayores son pero las cifras de pH expresan mayor acidez cuanto menores son. Un vino que presenta una Acidez Total de 7 g/l es más ácido que un vino que tiene una Acidez Total de 6 g/l pero un vino que presenta un pH de 3,4, sin embargo, es menos ácido que un vino que presenta un pH de 3,2. En la escala de pH cuanto más cerca estamos del 0 más acidez presenta el vino. Cuando decimos que el pH aumenta, es decir sube de cifra, estamos diciendo que disminuye la acidez y viceversa.
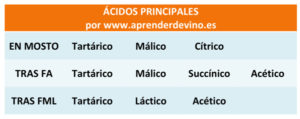 Las uvas van variando su contenido en sustancias ácidas a lo largo de su maduración por lo que los mostos obtenidos a partir de ellas tendrán una composición de ácidos, un nivel de Acidez Total y un pH diferentes en función del estado de maduración en que se vendimien. De la misma manera la distribución de los diferentes ácidos, la suma total de la acidez y el pH serán diferentes en los vinos resultantes de esos mostos tras la fermentación alcohólica y tras la fermentación maloláctica, en caso de que esta última se lleve a cabo. Tanto la fermentación alcohólica como la fermentación maloláctica tienden a reducir la Acidez Total del vino, elevando por tanto el pH.
Las uvas van variando su contenido en sustancias ácidas a lo largo de su maduración por lo que los mostos obtenidos a partir de ellas tendrán una composición de ácidos, un nivel de Acidez Total y un pH diferentes en función del estado de maduración en que se vendimien. De la misma manera la distribución de los diferentes ácidos, la suma total de la acidez y el pH serán diferentes en los vinos resultantes de esos mostos tras la fermentación alcohólica y tras la fermentación maloláctica, en caso de que esta última se lleve a cabo. Tanto la fermentación alcohólica como la fermentación maloláctica tienden a reducir la Acidez Total del vino, elevando por tanto el pH.
La cantidad de acidez es el elemento fundamental, pero no el único, que determina el pH de un vino. En este momento necesitamos recordar que como decíamos al principio, en aquella compleja definición, el pH refleja la concentración de iones hidrógeno. Cada uno de los ácidos que componen la suma de la Acidez Total del vino tiene una concentración de iones hidrógeno distinta y por lo tanto una contribución diferente en términos relativos al pH. El ácido tartárico es el que más contribuye y más cambios genera en el pH mientras que el málico, el cítrico o el láctico lo hacen en menor medida. Esta es una de las razones por las que las medidas de la Acidez Total y el pH, aunque presentan cierta correlación, no son coincidentes ni proporcionales. Dos vinos con igual nivel de Acidez Total pueden tener diferente pH y de la misma manera dos vinos con igual pH pueden tener diferente nivel de Acidez Total. Los vinos blancos que no han hecho la fermentación maloláctica suelen tener menor pH que los que han pasado por ella porque el ácido málico tiene mayor concentración de iones hidrógeno que el ácido láctico, en el que se metaboliza.
Otros de los elementos que hace que la relación entre Acidez Total y pH no sea proporcional es el potasio. Las sales de bitartrato de potasio, que en ocasiones observamos en la botella, se forman a partir de ácido tartárico y modifican la concentración de ácidos en el vino. Los mostos que presentan elevadas cantidades de potasio tienden a elaborar vinos con niveles de pH más altos.
El nivel de pH que presentan tanto el mosto como el vino también es muy importante porque juega un papel crítico en muchos aspectos de la vinificación y estabilidad del vino. El Dióxido de Azufre (SO2), principal encargado de proteger al vino de la oxidación y de las contaminaciones bacterianas, presenta una efectividad muy diferente en función del nivel de pH. A niveles elevados de pH el efecto protector del sulfuroso sobre el vino puede disminuir o incluso desaparecer. También el color depende del nivel de pH de una forma importante. Las altas concentraciones de iones que encontramos en los niveles bajos de pH facilitan que los taninos pigmentados, que colorean los vinos tintos, muestren un color rojo más brillante. Durante la maduración del vino el pH aumenta, estas moléculas cambian y comienza a mostrarse más apagado, apareciendo los colores amarronados.
 Aún a riesgo de generalizar, podemos considerar que los vinos que presentan un pH más bajo suelen más frescos y frutales, mantienen el carácter joven más tiempo mientras evolucionan y lo hacen más despacio, presentan menos cuerpo y complejidad, son más brillantes y rojos en el caso de los tintos y se muestran más estables y protegidos frente a los ataques microbianos. Por su parte los vinos que presentan un pH más alto suelen ser menos frescos y frutales, evolucionan más rápido, tienen más cuerpo, son menos brillantes y menos rojos (más marrones o azules) en el caso de los tintos, son menos estables y presentan más riesgo de contaminaciones microbianas.
Aún a riesgo de generalizar, podemos considerar que los vinos que presentan un pH más bajo suelen más frescos y frutales, mantienen el carácter joven más tiempo mientras evolucionan y lo hacen más despacio, presentan menos cuerpo y complejidad, son más brillantes y rojos en el caso de los tintos y se muestran más estables y protegidos frente a los ataques microbianos. Por su parte los vinos que presentan un pH más alto suelen ser menos frescos y frutales, evolucionan más rápido, tienen más cuerpo, son menos brillantes y menos rojos (más marrones o azules) en el caso de los tintos, son menos estables y presentan más riesgo de contaminaciones microbianas.
El clima en el que se desarrollan las uvas influye en el pH, en general las regiones de clima frío producen vinos con pH más bajos mientras que las regiones de clima cálido los producen con pH más altos. Debido al estilo que tradicionalmente han presentado los vinos en algunas regiones será habitual que se presenten casi siempre con un pH en la parte baja del intervalo más propio de su color, mientras que en otras regiones lo harán en la parte más alta de ese intervalo. El efecto del cambio climático y la búsqueda de una mayor maduración fenólica para conseguir vinos potentes, tan de moda en estos últimos tiempos, han llevado a prolongar el tiempo que las uvas permanecen en la planta, con la consiguiente elevación general del pH en los vinos de muchas regiones.
Finalmente, no está de más recordar que tanto el pH como la Acidez Total deberán estar en relación y equilibrio con otras características del vino, como alcohol, taninos y azúcar, para definir su sabor.

Ricardo Sanchoyarto es el autor de este artículo. Es formador y divulgador del vino además de editor y propietario de Aprender de Vino.

